Niezwykła i ciekawa chemia
Elektroliza chlorku sodu
Otrzymujemy gazy wodór i chlor w procesie elektrolizy chlorku sodu (soli kuchennej).
Do doświadczenia potrzebne będą
- sól kuchenna
- źródło prądu elektrycznego (bateryjka, zasilacz 12V np. antenowy, niepotrzebna ładowarka np. od telefonu)
- naczynie z wodą (w którym rozpuszczona będzie sól)
- elektrody grafitowe (rysik z ołówka lub elektroda z baterii)
Instrukcja
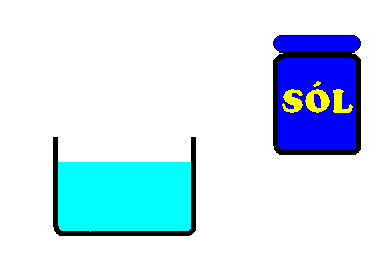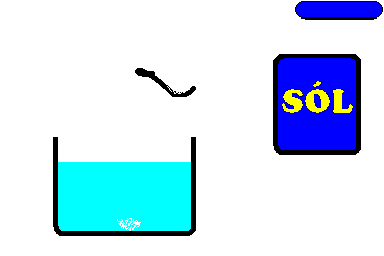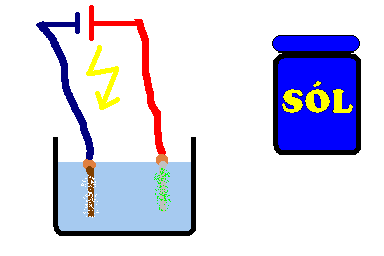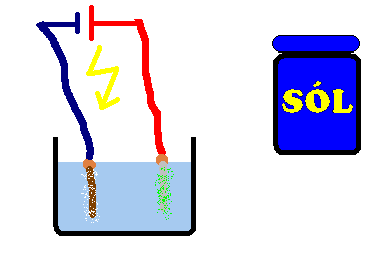
Sól rozpuszczamy w wodzie, najlepiej do momentu aż roztwór będzie nasycony. W przypadku użycia baterii 4.5V, do styków przymocowujemy kabelki. Do końców tych kabelków, lub kabli z zasilacza/ładowarki podłączamy elektrody. Przy "minusie" elektrodą może być dowolny przewodnik (gwóźdź, śruba, itp.), ale przy "plusie" musimy zastosować elektrodę grafitową (najlepszy będzie długi rysik z ołówka, trzeba obrać nożem ołówek z drewna). Jeśli nie wiesz gdzie jest "plus" a gdzie "minus", zastosuj po obu stronach elektrody grafitowe. Całość wkładamy do roztworu soli i obserwujemy efekty. W przypadku użycie elektrody metalowej zamiast grafitowej, otrzymamy chlorki tych metali (chlorek miedzi - jasnozielony lub żelaza - ciemnozielony itp), które po pewnym czasie przemienią się w nierozpuszczalne osady wodorotlenków (żelaza - pomarańczowy, miedzi - niebieski).
Dlaczego tak się dzieje?
W czasie rozpuszczania sól ulega dysocjacji czyli rozpada się na kationy Na+ i aniony Cl-. Kiedy płynie prąd elektryczny, jony Na+ wędrują do elektrody ujemnej gdzie stają się sodem, który natychmiast reaguje z wodą tworząc wodorotlenek sodu (NaOH) i wodór (H2). 2Na + 2H2O › 2NaOH + H2↑ Z kolei jony Cl- wędrują do dodatniej elektrody gdzie tracą ładunek elektryczny i stają się obojętnym chlorem (Cl2).